El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en agua si puede interaccionar con las moléculas de la misma mediante puentes de hidrógeno o interacciones del tipo ión-dipolo.
Solubilidad de iones en agua
Con aniones que tengan átomos de oxígeno (CO32-, SO42-, NO -) pueden formar puentes de hidrógeno, dado que el oxígeno actúa como aceptor de los mismos. Además, hay que tener en cuenta la atracción del anión sobre el dipolo del agua. Lo mismo ocurre con Cl- o F-, que tienen pares de electrones solitarios y que pueden actuar como aceptores de puentes de hidrógeno. Por su parte, los cationes como el Na+, el K+, el Ca++ o el Mg++ se rodean de moléculas de agua a las que unen mediante interacciones del tipo ión dipolo; los átomos de oxígeno se orientan hacia el catión.
 |
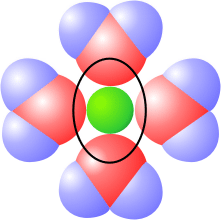 |
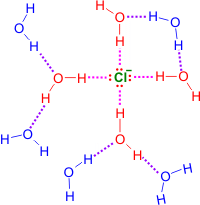
| El cloruro tiene 4 pares de electrones solitarios, que actúan como aceptores de 4 puentes de hidrógeno. Las 4 moléculas unidas directamente al anión (en rojo) forman la primera capa de solvatación, difícil de separar del cloruro. Estas 4 moléculas están, a su vez, unidas a una segunda capa de moléculas de agua, de las que se muestras sólo 5 (en azul) | El ión Na+ (dibujado a escala en la imagen) puede unir hasta un máximo de 6 moléculas de agua, 4 en un plano y dos más en las caras inferior y superior (representada como una elipse) del mismo. A estas moléculas de agua se unen otras, hasta un total de unas 16 moléculas de agua asociadas al Na+ |
En cualquier caso el ión se rodea de una capa de moléculas de agua (atmósfera de solvatación). Estas moléculas, a su vez, orientan a las moléculas de agua vecinas, y así sucesivamente; las moléculas más externas se intercambian continuamente con las moléculas de agua del medio. En principio, cuanto más pequeño y más cargado el ión, es decir, cuanto mayor sea su densidad de carga, más fuertemente une a las moléculas de agua, aunque hay discusión sobre el número de moléculas de agua que se pueden considerar como fuertemente unidas a un catión (4 o 6 para el Na+. por ejemplo). Por otra parte, este número puede depender de la presencia de otros iones en el medio. Los cationes metálicos como el Fe3+ se unen a 6 moléculas de agua por enlaces dativos (de coordinación) muy fuertes. Las moléculas de agua se llegar a ionizar al aumentar el pH -hidrólisis de los cationes-; las propiedades específicas de estos complejos no serán tratadas en este tema.
Solubilidad en agua de moléculas neutras.
Las moléculas neutras son solubles -miscibles- en agua si pueden formar puentes de hidrógeno, como aceptoras (acetona), donadoras (mercaptoetanol) o ambas ( etanol). La solubilidad de moléculas más grandes y complejas depende del número de grupos (iónicos, polares) que tenga y de la geometría de la molécula.
|
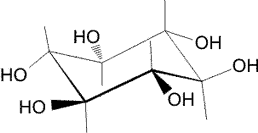
Modelo de hidratación del
escilo-inositol. Cada uno de los seis grupos -OH une a 2 moléculas de agua, una como donador y otra como aceptor (arriba). En total, 12 moléculas de agua que, a su vez, se unen por puentes de hidrógeno a moléculas de agua vecinas (arriba-derecha). Note que los hidrógenos unidos al carbono no forman puentes de hidrógeno (oxígeno e hidrógeno del agua en púrpura y cian, respectivamente) El isómero mas frecuente no es éste, sino el meso-inositol |
 |
|