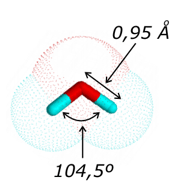
El agua es una de las sustancias más peculiares conocidas. Es una molécula pequeña y sencilla, pero tras su aparente simplicidad presenta una complejidad sorprendente que la hace especialmente útil para la vida.
 |
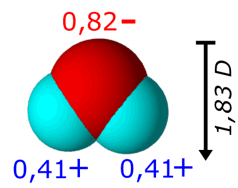 |
Las moléculas de agua están fuertemente unidas entre sí. Un aspecto paradójico es que el agua es un líquido, aunque sus moléculas se encuentren en promedio fuertemente unidas. Este fenómeno se debe al carácter transitorio de los puentes de hidrógeno, que al formarse y romperse continuamente permiten la movilidad de las moléculas de agua. Una molécula de agua puede unirse a un máximo de otras 4 moléculas por puentes de hidrógeno, actuando en dos de ellos como donadora y en otros dos como aceptora:
|
Modelo del hielo cúbico
Se pueden ver muy bien los 4 puentes de hidrógeno que forma la molécula de agua central. Esta forma de hielo aparece a temperaturas inferiores a -60ºC. Los cristales de hielo que se encuentra habitualmente tienen simetría hexagonal, aunque también hay 4 puentes de hidrógeno por molécula de agua. |
|
En el hielo estos puentes de hidrógeno son más o menos estables, * mientras que en el agua líquida tienen un carácter transitorio, estimándose que tiene una vida media del orden de picosegundos. En resumen, podemos considerar el agua líquida como una red "infinita" de puentes de hidrógeno en continua creación y ruptura. Por otra parte, existen evidencias de que las moléculas de agua se asocian formando agrupaciones -"clusters"- de moléculas de vida relativamente larga, en el que las moléculas mantienen una red de puentes de hidrógeno bastante estable en su conjunto.
|
Agua en estado líquido La estructura aparece como muy desordenada, aunque pueden apreciarse grupos y cadenas de moléculas de agua unidas por puentes de hidrógeno |
Se estimaba que, en promedio una molécula de agua está unida por 3,5 puentes de hidrógeno. Sin embargo, estudios recientes parecen apuntar a que el número medio de puentes de hidrógeno es algo menor; un 80% de las moléculas estarían unidas por sólo dos puentes de hidrógeno fuertes, mientras que el 20% restante estarían unidas hasta por 4 puentes de hidrógeno fuertes en disposición tetraédrica. Hay que hacer notar que el aumento de la densidad del hielo al fundirse se debe a que los enlaces de hidrógeno tienden a separar ligeramente a las moléculas de agua respecto a su distancia de Van der Waals. En otras palabras, las moléculas de agua están más separadas, en promedio, cuando están unidas por cuatro puentes de hidrógeno que cuando el número de puentes de hidrógeno por molécula es menor. En cualquier caso las moléculas de agua están fuertemente unidas entre sí: la energía máxima de un puente de hidrógeno agua-agua es de unos 23,3 kJ/mol; además, hay que tener en cuenta las interacciones de Van der Waals entre moléculas próximas, que pueden suponer hasta unos 5 kJ/mol adicionales. Por consiguiente es necesario suministrar mucha energía para hacer que las moléculas de agua se separen. Por esto el agua presenta las temperaturas de fusión y de ebullición, así como el calor específico, más elevado de todas las moléculas similares.
Propiedades ácido-base
El agua puede disociarse con una probabilidad muy pequeña. Además, los iones recién formados al disociarse el agua tienden a atraerse y recombinarse rápidamente. Por consiguiente su concentración en el agua pura es muy baja, 1x10-7 M (compárese con la concentración de agua sin disociar, de 55,5 M)
Hay que tener en cuenta que no se encuentran iones H+ "desnudos", es decir, protones, a pesar de que se emplee esa nomenclatura habitualmente. Lo que hay son iones hidronio H3O+, que a su vez se encuentran hidratados. Igualmente sucede con los aniones HO-, que se encuentran fuertemente asociados a moléculas de agua.
| El ión hidronio,
H3O+ La carga positiva se encuentra distribuida por el conjunto del ión; los tres hidrógenos son indistinguibles. |
|
Curiosidad. ¿Cuántos iones H3O+ hay en una bacteria esférica de 2 µm de diámetro, suponiendo que su interior está a pH 7,0?. Para conocer la respuesta, pulse aquí. |
Transporte de "protones" a través del agua.
La existencia de resonancia en el enlace de hidrógeno hace que la movilidad del ión H3O+ en el agua sea mucho mayor que la de cualquier otro ión, dado que se puede transferir la carga a gran distancia y rápidamente, en vez de moverse el ión como tal:
|
Realmente no se mueve físicamente el ión hidronio como tal (abajo), sino que los hidrogeniones "saltan" rápidamente entre las moléculas de agua unidas por puentes de hidrógeno (arriba). |
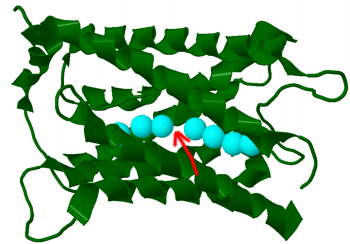
Este fenómeno plantea un problema interesante para las proteínas transportadoras de agua en las membranas o acuaporinas: deben permitir el paso de moléculas de agua SIN que pasen simultáneamente hidrogeniones, ya que en este caso se disiparía el potencial de membrana. Lo consiguen separando y obligando a girar a las moléculas de agua, formado un puente de hidrógeno específico, con lo que rompen la red de puentes de hidrógeno que las unen y que permite el paso rápido de los hidrogeniones. Además, un resto cargado positivamente en el canal actúa como barrera para el movimiento de cationes.
 |
|
Acuaporina de cristalino bovino. Archivo 1YMG.pdb. Observe que la cadena de moléculas de agua (oxígenos en azul) que atraviesan el interior polar de la proteína se encuentra físicamente interrumpida en el centro del canal (flecha roja) |
* Los puentes de hídrógeno en el hielo no son completamente estables, aunque su vida media es superior que en el agua líquida.