Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad, de tal forma que cuando se crea un enlace covalente, los dos electrones del enlace son atraídos con distinta fuerza por los átomos que los comparten. En resumen, el orbital molecular pierde su simetría, y la probabilidad de encontrar los electrones se hace mayor en las proximidades del átomo más electronegativo. Se sigue conservando la neutralidad eléctrica global, pero sobre el átomo más electronegativo hay un predominio de carga negativa mientras que sobre el átomo menos electronegativo hay un predominio de carga positiva: se ha formado un dipolo. La magnitud de ese dipolo viene definida por lo que se conoce como momento dipolar, y es el producto de la carga fraccional presente sobre cada átomo por la distancia que las separa. La unidad de momento dipolar es el debye; 1 D = 3,34 x 10-30 Culombio x m.
| Molécula diatómica sin momento dipolar | Distorsión de la nube electrónica entre dos átomos con diferente electronegatividad |
|
|
|
El orden relativo de electronegatividad de varios elementos es el siguiente (en rojo se muestran los presentes en las biomoléculas):
|
F
(4,0) > O
(3,5) > N, Cl (3,0) > C, S,
(2,5) ~ H (2,2), P
(2,1) |
| El número entre paréntesis corresponde a la cuantificación de la electronegatividad según Pauling. |
La separación de cargas en un enlace covalente es tanto mayor cuanto mayor sea la diferencia de electronegatividades entre los átomos que lo forman. Esto quiere decir que un enlace entre dos átomos de C, o entre un C y un H tiene una distribución prácticamente homogénea de los electrones, esto es, de la carga, mientras que un enlace C-O tiene la nube electrónica más desplazada hacia el oxígeno, al ser este elemento más electronegativo que el carbono. Así, en un enlace sencillo C-O el oxígeno tiene aproximadamente un 0,2 de carga negativa (y el C un 0,2 de carga positiva), mientras que en un enlace H-O la carga sobre cada átomo es del orden de 0,4; evidentemente, también en este caso el exceso de carga negativa corresponde al átomo de oxígeno. Se estima que una diferencia de electronegatividades del orden de 2 unidades supone una carga fraccional de 0,5 o, lo que es lo mismo, que el enlace tiene un 50% de carácter iónico.
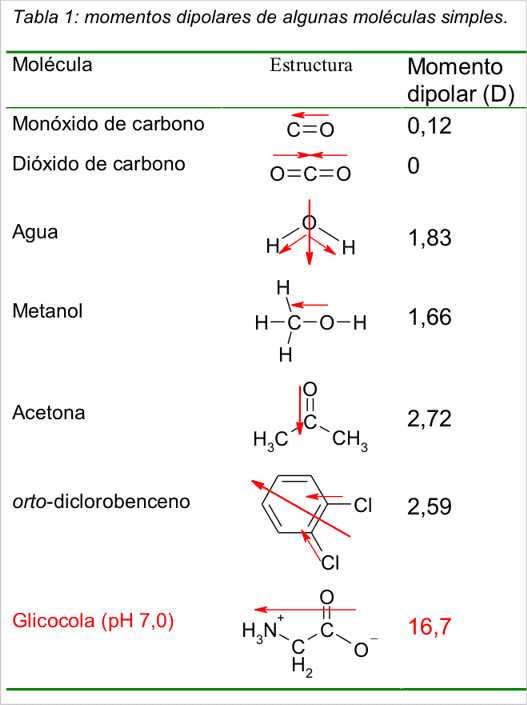
Note el elevado momento dipolar de la acetona. Se debe a que el enlace p entre el carbono carbonílico y el oxígeno se encuentra mucho más polarizado que los enlaces s formados entre el oxígeno y el carbono o el hidrógeno.
Estos dipolos, aunque
globalmente neutros, pueden interaccionar exactamente igual que las moléculas
con carga neta, aunque la energía de esa interacción será comparativamente
menor dado que la carga presente también lo es.