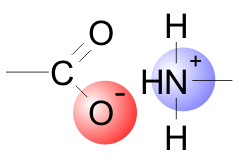
Se llevan a cabo entre iones, por consiguiente con carga eléctrica neta. Pueden participar tanto grupos funcionales cargados (carboxilo, amino) como iones inorgánicos, y pueden ser tanto de atracción, si los iones tienen cargas opuestas como de repulsión, si presentan igual carga. Ambos tipos de interacción son importantes en las biomoléculas, y por ello se tratan aquí como interacciones iónicas, y no como enlaces iónicos exclusivamente. Los enlaces iónicos se denominan a veces "puentes salinos", aunque esta es una denominación anticuada y poco precisa.
La fuerza de una interacción de tipo electrostático viene dada por la ley de Coulomb, pero el parámetro que aquí nos interesa es la energía necesaria para romper un enlace iónico (energía necesaria para separar dos grupos de distinta carga desde la distancia r hasta el infinito), o la energía necesaria para acercar dos grupos con igual carga hasta la distancia r. Esta energía viene dada por la expresión:
 |
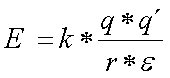
|
q y q´ son las cargas de los iones considerados, k una constante de proporcionalidad, r la distancia entre los iones y e la constante dieléctrica |
La constante dieléctrica e depende el medio, y es un parámetro que indica el grado de apantallamiento que sufre el campo eléctrico en el medio en el cual se encuentran las cargas. En el vacío vale 1, en hidrocarburos aproximadamente 2, mientras que en el agua, y debido a su elevado momento dipolar, la carga se apantalla rápidamente; la constante dieléctrica tiene en este caso un valor de 78,5: por consiguiente las interacciones electrostáticas son mucho menos intensas en medio acuoso que en un medio apolar. Por otra parte, la presencia de iones en disolución, lo que es lo habitual en el medio celular, contribuye a que el apantallamiento del campo eléctrico sea muy eficiente. De hecho, se puede asumir que, en sistemas biológicos acuosos, las interacciones iónicas dejan de tener importancia a distancias superiores a 1 nm, más o menos. Distinta puede ser la situación en medios hidrofóbicos libres de cargas, como el interior hidrofóbico de las membranas o el interior de las proteínas, en las que el efecto de las cargas eléctricas puede alcanzar distancias superiores resultando en interacciones electrostáticas significativas entre cargas alejadas del orden de varios nm. Por otro lado, el efecto de apantallamiento debido al agua depende del número de moléculas de agua que se interpongan entre las cargas a considerar, por lo que dos grupos cargados situados muy próximos en la superficie de una proteína podrían interaccionar fuertemente a pesar de encontrase teóricamente en medio líquido si entre ellos no se encuentran moléculas del disolvente.
Son características importantes de las interacciones iónicas, además de su dependencia de la constante dieléctrica del medio:
|
|
No direccionalidad:
Los grupos cargados van a interaccionar con la misma fuerza, independientemente de su orientación relativa. |
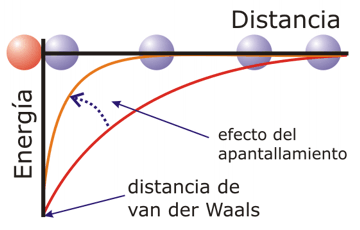 |
Dependencia de la distancia:
La energía de la interacción disminuye en función del inverso de la distancia al separar las cargas, haya o no apantallamiento. El apantallamiento hace que la energía de la interacción disminuya más rápidamente con la distancia. |
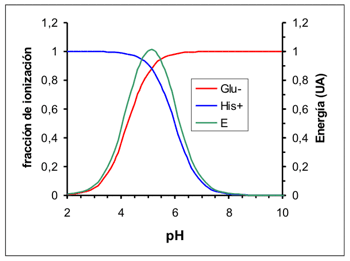 |
Dependencia del pH (no siempre)
Los grupos iónicos de las biomoléculas son generalmente ácidos o bases débiles, cuyo grado de ionización depende del pH. En este ejemplo se muestra la energía de enlace (en unidades arbitrarias) entre un resto de ácido glutámico (pK 4,25) y un resto de histidina (pK 6,00) |
Teniendo en cuenta todo lo anterior, está claro que no se puede dar un valor preciso para la energía de este tipo de interacciones, pero en general se puede admitir que presentan un valor de 10 a 70 kJ/mol, teniendo este último valor en condiciones excepcionales.
Además de la importancia que tienen en la unión de restos cargados de aminoácidos, son fundamentales para la unión de iones inorgánicos a las biomoléculas.
 |
Enlace iónico en la prostaglandina sintasa I humana. En este caso la estructura se ha determinado por difracción de rayos x, y los hidrógenos no son visibles en la imagen. Archivo PDB: 1PTH |
|
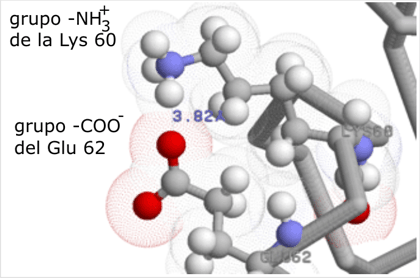
|
Enlace iónico en la superficie del citocromo c de caballo. La estructura se ha determinado por RMN, por lo que son visibles los hidrógenos y se puede apreciar directamente el grado de ionización. Archivo PDB: 1AKK |
||
| Note que en estos ejemplos la distancia entre las cargas es muy pequeña y no se encuentran próximas moléculas de agua ni otros iones, por lo que la energía de estos enlaces debe ser relativamente alta. | ||
A pesar de que la presencia de agua y otros iones apantalla las interacciones iónicas, éstas son las únicas que se transmiten a cierta distancia, aunque sea corta; los restantes tipos de interacción no-covalente requieren prácticamente el contacto directo entre los grupos que interactúan. Además, la distribución de cargas en la superficie de las macromoléculas puede crear campos eléctricos de importancia para la orientación y acercamiento de otras moléculas sobre su superficie.