Una molécula con momento dipolar puede interaccionar con un ión, o bien con otra molécula dipolar. En ambos casos hay una diferencia muy importante con las interacciones iónicas: ahora la orientación de los grupos que interactúan es muy importante, hasta tal punto que, en función de la orientación relativa, puede haber atracción o repulsión entre los grupos interactuantes.
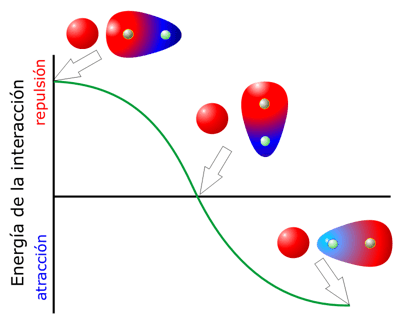
La dependencia de la energía de la interacción respecto la distancia es compleja. En el caso de que la orientación del dipolo o dipolos sea constante, es decir, que los dipolos estén fijos (por ejemplo, si forman parte de la estructura de una macromolécula), la energía varía respecto la distancia en función de 1/r2 para una interacción ión-dipolo, y en función de 1/r3 para una interacción dipolo-dipolo. Si, por el contrario, los dipolos pueden moverse libremente, y teniendo en cuenta que las moléculas a temperatura ambiente se mueven constantemente, los efectos estadísticos del movimiento hacen que estas interacciones sean importantes a distancias más cortas, de tal forma que, en el caso de ión-dipolo dependen de 1/r4 y en el caso de interacciones dipolo-dipolo de 1/r6, es decir, que son importantes sólo cuando están prácticamente en contacto. Por otra parte, el efecto del apantallamiento del campo eléctrico que se discutió anteriormente es también aplicable a esta situación, por lo que en general este tipo de interacciones son significativas sólo a muy cortas distancias o en medios apolares.
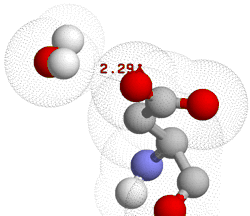
Dentro de este campo destacan por su importancia las interacciones de iones y grupos cargados con moléculas de agua, que originan la denominada "atmósfera de solvatación".
 |
|
| Dos vistas de la unión de una molécula de agua al grupo carboxilo terminal del Asp 32 superficial del citocromo c´ de Rodopseudomonas. El agua se une a través de la parte positiva de su dipolo (uno de los hidrógenos) al oxígeno aniónico del aspartato. Archivo PDB: 1CPQ | |