Por definición, una sustancia es hidrofóbica si no es miscible con el agua. Básicamente la hidrofobicidad ocurre cuando la molécula en cuestión no es capaz de interaccionar con las moléculas de agua ni por interacciones ión-dipolo ni mediante puentes de hidrógeno. Tal es el caso de los hidrocarburos saturados. En esta situación las moléculas de agua en la vecindad del hidrocarburo se orientan y se asocian formando una estructura parecida al hielo, creándose una especie de jaula de moléculas de agua alrededor de la molécula hidrofóbica. Esta estructura se conoce como clatrato.
|
Clatrato Modelo de una molécula de ciclohexano (en amarillo; no se muestran sus hidrógenos) rodeada de moléculas de agua. en la imagen de la derecha se han eliminado las moléculas delanteras para poder apreciar la estructura de la "jaula" y la falta de enlaces entre el ciclohexano y el agua. Compare con el modelo inositol-agua, en el que sí que hay puentes de hidrógeno. Note además que alguno de los hidrógenos del agua (en azul) no puede formar puentes de hidrógeno en el clatrato. |
|
En resumen, una molécula que no pueda interaccionar con el agua incrementa el orden del agua a su alrededor, es decir, disminuye la entropía del agua.
Supongamos que tenemos dos moléculas de un hidrocarburo. El sistema agua + hidrocarburo puede estar en dos estados diferentes:
 |
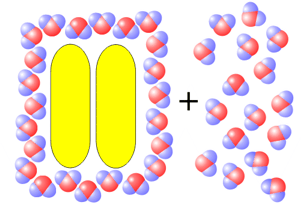 |
|
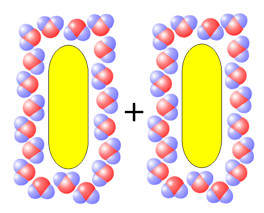
Estado 1 Las dos moléculas de hidrocarburo están separadas, y cada una tiene su propia "jaula" de moléculas de agua ordenadas alrededor |
Estado 2 Las dos moléculas de hidrocarburo están juntas, compartiendo una "jaula" de moléculas de agua común. El número total de moléculas de agua que forman el clatrato es menor, por lo que parte de las moléculas que estaban fijas está libres en la disolución (cuente las moléculas) |
El estado más estable de estos dos posibles será el de menor energía libre DG:
![]()
En este caso el estado más estable será el de mayor entropía, o, lo que es lo mismo, el que tenga menos moléculas de agua ordenadas, ya que la variación de entalpía en este caso es prácticamente nula 1. Por consiguiente, el sistema se dispone espontáneamente en el estado 2, en el que las dos moléculas de hidrocarburo están juntas, simplemente porque el desorden del agua es mayor en ese estado.
¡No es que el ciclohexano “huya” del agua!. Es que el agua “expulsa” al ciclohexano de su interior. Ciertamente, las moléculas de ciclohexano se van a unir entre sí por fuerzas de dispersión, pero como estas interacciones se forman entre cualesquiera moléculas, la contribución neta de estas interacciones a la energía del efecto hidrofóbico se puede considerar pequeña. De hecho, las moléculas de ciclohexano disueltas en decano, por ejemplo, no muestran ninguna tendencia a unirse entre sí. Las interacciones hidrofóbicas dependen exclusivamente de la estructura del agua, y aparecen siempre que se mezclen agua y otra sustancia que no interaccione con ella.
Es muy importante destacar que la energía de las interacciones hidrofóbicas aumenta al aumentar la temperatura, ya que el término exergónico en la variación de energía libre es -TDS; además, el desorden del agua también aumenta con la temperatura, por lo que la fuerza responsable de las interacciones hidrofóbicas (DS) es mayor a temperaturas más elevadas. No es de extrañar, por consiguiente, que las proteínas de los organismos termófilos e hipertermófilos dependan de interacciones hidrofóbicas en mayor medida que las de otros organismos para el mantenimiento de su conformación nativa.
El mejor ejemplo de estructura celular dependiente exclusivamente de las interacciones hidrofóbicas lo son las membranas:
|
Simulación de una bicapa lipídica de fosfatidilcolina en
estado fluído.
Las moléculas de agua, muy desorganizadas pero unidas entre sí por puentes de hidrógeno, se encuentran en las dos caras de la bicapa. No atraviesan el interior de la membrana, altamente hidrofóbico. En este interior las cadenas de ácidos grasos están estrechamente unidas. La estructura es muy dinámica -el interior es prácticamente un fluido bidimensional- pero resulta muy estable debido al intenso efecto hidrofóbico.
|
1 Es posible que haya una variación de entalpía negativa en la transición 1->2 si el número de puentes de hidrógeno que forman las moléculas de agua en el clatrato es menor del que formarían en agua líquida, como ocurre en la figura. Este efecto se sumaría a la variación de entropía, e incrementaría la energía de la interacción hidrofóbica.