Se dice que una proteína es específica para un ligando L cuando la Kd de dicha proteína para ese ligando es menor que los valores de Kd para ligandos similares. Es decir, el ligando L se ajusta mejor al sitio de unión que otras moléculas. Recuerde que el valor de Kd depende críticamente de que se puedan establecer un número elevado de interacciones débiles entre el ligando y la proteína.
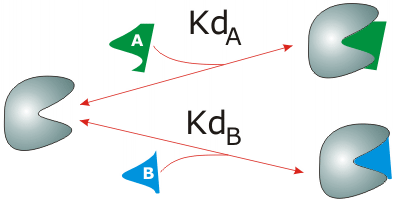
Es perfectamente posible que una proteína pueda unir diferentes ligandos en el mismo sitio de unión, si sus estructuras son similares. Si solo cabe uno de los dos posibles ligandos en el sitio de unión, ambas moléculas compiten por unirse a la proteína; en ese caso se tienen estos dos posibles equilibrios, y las correspondientes ecuaciones de saturación:
 |
Saturación de P | |
| por el ligando A | por el ligando B | |
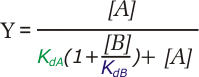 |
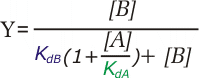 |
|
En este caso se puede ver que la presencia de B disminuye la formación del complejo PLA, y viceversa. La competencia entre ligandos es un campo muy importante, y está en la base de la actuación de un número muy elevado de fármacos.
 |
|
|
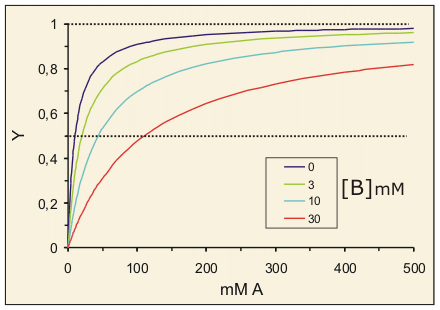
Efecto de concentraciones crecientes del ligando B sobre la saturación de la proteína por el ligando A. Note que al aumentar la concentración de B la saturación de la proteína por A disminuye, pero este efecto es cada vez menor al aumentar la concentración del primer ligando. A concentraciones suficientemente altas de A, el efecto de B es insignificante. El efecto de B es el de disminuir la afinidad aparente de la proteína hacia A, como se puede apreciar en la representación de Scatchard de los datos. KdA, 10 mM; KdB, 3 mM
|
|
En el caso de que la proteína sea una enzima la competencia entre los ligandos da lugar a la inhibición reversible competitiva. En el caso de que la proteína sea un receptor se ha desarrollado una nomenclatura específica que conviene conocer. Las moléculas que compiten por el ligando por unirse a la proteína se denomina agonistas o antagonistas del ligando en cuestión. Ambos tipos se unen al mismo sitio que el ligando, pero sus efectos fisiológicos son muy distintos:
|
|
|
|
Agonista: molécula que compite con el ligando fisiológico por la unión pero induce el mismo cambio que el ligando en el receptor, por lo que éste último actúa igual que si tuviera el ligando fisiológico unido. |
Antagonista: molécula que compite con el ligando fisiológico por la unión al receptor pero que no induce ningún efecto sobre el mismo. El receptor no lleva a cabo su función específica. |
Ejemplo de agonistas y antagonistas de la hormona adrenalina:
| Ligando | Tipo de receptor | |||
|
a adrenérgico |
b adrenérgico |
|||
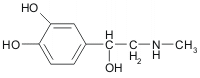 |
adrenalina | fisiológico | 0,23 mM | 5 mM |
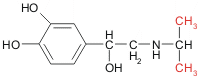 |
isoproterenol | agonista | 30 mM | 0,4 mM |
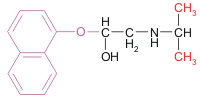 |
propanolol | antagonista | 27 mM | 3,4 nM |
|
Valores típicos de Kd para tres ligandos en dos tipos de receptores adrenérgicos Si comparamos estas estructuras entre sí podemos ver que:
|
||||