El hecho de que la curva de saturación sea hiperbólica tiene algunas consecuencias interesantes. En primer lugar, si la concentración de ligando es inferior a la Kd, la saturación depende casi linealmente de la concentración de ligando. Hay una proporcionalidad casi perfecta entre ambas:
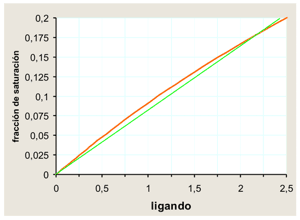 |
En el ejemplo se supone que la Kd vale 10 unidades. En rojo, la curva de saturación calculada. En verde, ajuste lineal. |
Por el contrario, a concentraciones de ligando superiores a 10 veces Kd la fracción de saturación resulta prácticamente independiente de la concentración del ligando:
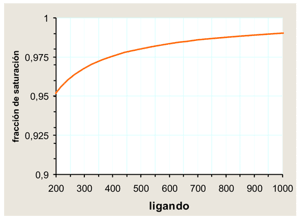 |
Kd, 10 unidades. Note ambas escalas; un cambio de concentración de 200 a 1000 unidades se traduce en un incremento de la saturación mínimo, de 0,95 a 0,98. |
Cuando la proteína está saturada por encima del 50%, para incrementar la saturación de la proteína en un factor pequeño es preciso aumentar mucho la concentración del ligando. Este comportamiento es antiintuitivo: tendemos a pensar que al duplicar la cantidad total de ligando se aumenta en la misma medida la cantidad del ligando unido, pero no es así. Tal vez un ejemplo teórico permita entender mejor lo que esto significa.
Supongamos que en un volumen unidad tenemos 10 unidades de proteína capaz de asociarse con un ligando L, con una Kd de 50 unidades por unidad de volumen. Podemos imaginar que 1 unidad de proteína o de ligando representa una molécula, o una cantidad mayor, como un picomol; para el caso de este ejemplo es lo mismo. Veamos como cambia la saturación en función de la cantidad de ligando presente en el medio, representando gráficamente las moléculas de proteína y ligando unidas y libres, tras aplicar la ecuación #6
| Cuando la concentración de ligando es igual a la Kd, la mitad de las moléculas de proteína están unidas a una molécula del ligando; hay 5 proteínas y 45 unidades de ligando sin unirse | 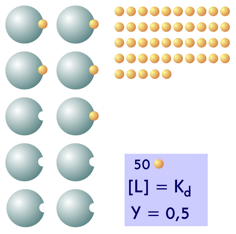 |
| Para aumentar la fracción de saturación a 0,7 (7 de cada 10 unidades de proteína con ligando) hay que aumentar más del doble la cantidad de ligando: se requieren 120 unidades. Hay 3 unidades de proteína y 113 unidades de ligando libres. | 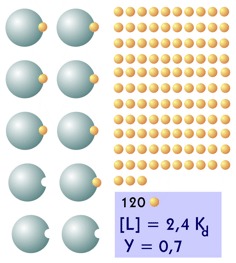 |
| El siguiente incremento de la fracción de saturación, de 0,7 a 0,8, supone que hay que aumentar mucho más la cantidad de ligando. Ahora hay 2 unidades de proteína y 192 de ligando libres. | 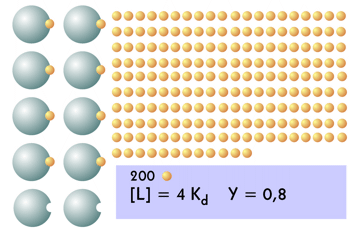 |
| Por último, el alcanzar el 0,9 de saturación supone una cantidad enorme de ligando: se requiere una cantidad 9 veces el valor de Kd para llegar a ese valor. Hay una unidad de proteína y 441 del ligando sin unirse. Pasar de 0,8 a 0,9 (aumento de una unidad de ligando unido), supone añadir ¡250 unidades del mismo!. | 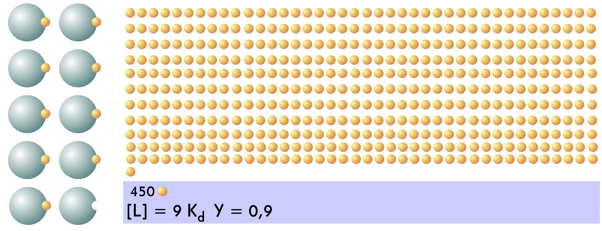 |
Está clara la falta de proporcionalidad entre el incremento de la concentración del ligando y el aumento de la fracción de saturación. De todas formas hay algo en el ejemplo anterior que puede parecer extraño, sobre todo en el último caso. ¿Porqué la proteína que está libre no une una molécula de ligando, habiendo tantas donde escoger?. ¿Cómo "sabe" esa unidad de proteína que le "toca" ser la que se queda libre, deambulando solitaria entre la multitud de moléculas de ligando?.
Evidentemente, la situación que se muestra en el ejemplo anterior es una simplificación. Correcta desde el punto de vista de la aplicación de la ecuación #6 , pero no se ajusta a la realidad en el sentido de que la unión y la disociación del ligando son procesos dinámicos, y no estáticos como parece deducirse del anterior ejemplo.
| Es preciso recordar que se trata de un equilibrio, de tal manera que las moléculas de proteína están soltando y tomando continuamente el ligando. En promedio, la saturación se mantiene constante (0,8 en esta animación). Pero no es posible conocer con exactitud el estado de una molécula individual |
En la anterior animación se puede ver que el valor de la saturación depende del tiempo que permanezca el complejo formado. Esto nos lleva a estudiar con más detenimiento el significado de las constantes K1 y K-1.