Es importante considerar la variación de la energía libre que se produce en la formación del complejo proteína ligando. Para empezar, veamos cuales son las situaciones inicial y final en el sistema proteína y ligando (sin olvidar las moléculas de agua en la que se encuentran ambos disueltos):
| El sistema puede estar en dos estados. I: la proteína y el ligando separados, e interaccionando con moléculas de agua, y II, el complejo proteína ligando formado; las moléculas de agua que antes estaban unidas a la proteína y al ligando ahora se encuentran formando parte del conjunto de disolvente. |
La asociación es exergónica, y por consiguiente la disociación es endergónica; -si fuese al revés el complejo no se formaría- .El valor absoluto de la variación de energía libre será el mismo en ambos casos, pero el signo de la misma será opuesto. Es muy importante tener en cuenta que la variación de energía libre depende, no solo de los enlaces -iónicos, de hidrógeno, de van der Waals- que se formen entre la proteína y el ligando, sino también de las interacciones con y entre las moléculas de agua. Lo que resulta significativo es la variación global de la energía libre en el conjunto del sistema proteína-ligando-disolvente.
La variación de la energía libre en condiciones estándar (concentración 1 M de reactantes, pH 7,0, 25º C) está relacionada con la constante de equilibrio de la reacción por la expresión:
| #7 | Siendo R la constante de los gases y T la temperatura absoluta |
En nuestro caso, si queremos saber la energía que se libera cuando se asocian la proteína y el ligando, suponiendo que el sistema se encuentra en equilibrio, y teniendo en cuenta que vamos a emplear habitualmente Kd, que es la constante de equilibrio de disociación, se cumple que:
| #8 |
Como era de esperar, cuanto menor sea Kd mas exergónica será la formación del complejo P.L; más favorecida está la asociación y mas desfavorecida está la disociación del complejo. Es fácil calcular el valor de DGº´que corresponde a un valor de Kd; algunos ejemplos se muestran en la siguiente tabla (la temperatura se ha supuesto 25º C o 298,15º K):
| Tabla 2 |
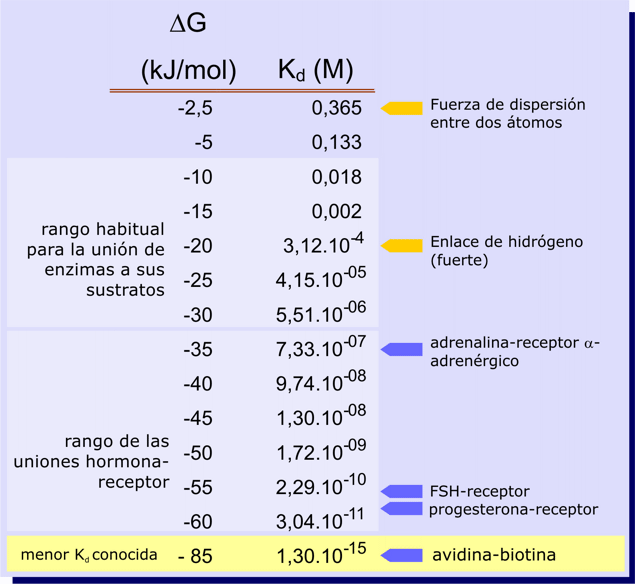 |
| FSH: hormona folículo estimulante |
Es interesante ver que un cambio pequeño en la variación de energía libre estándar corresponde a un cambio muy notable en el valor de Kd. Y además, con valores relativamente bajos de DGº´ se encuentran valores de Kd significativos desde el punto de vista funcional. Por ejemplo, sea un complejo cuya formación ocurre con una variación de energía libre neta de -15 kJ/mol, equivalente a la resultante de unos 7-10 átomos unidos por fuerzas de dispersión de London; esto es suficiente para que Kd alcance el valor típico de muchas interacciones entre enzimas y sus sustratos. En este punto hay que recordar que la energía de estas interacciones depende críticamente de la distancia [Tema 3: interacciones no covalentes] y son importantes exclusivamente a distancias interatómicas extremadamente pequeñas. Así, una complementariedad perfecta entre las formas del sitio de unión y del ligando, que permita el contacto directo de muchos átomos y por consiguiente el establecimiento de un número elevado de enlaces débiles, dará lugar a valores de Kd bajos. Cualquier alteración en la forma del ligando, que no permita ese ajuste perfecto, se traducirá en un aumento importante del valor de Kd. Otro tanto cabe decir de los puentes de hidrógeno, que requieren una orientación precisa para ser energéticamente significativos.
 |
Un cambio pequeño en una zona concreta del ligando puede impedir el ajuste en el conjunto del sitio de unión, u obligar a un cambio conformacional, energéticamente costoso, en la molécula de proteína. |
El valor más bajo de Kd (y, por consiguiente la afinidad más elevada) que he encontrado para un par proteína-ligando es el correspondiente a la unión de la vitamina biotina por la avidina, una proteína de la clara de huevo. No hay una razón biológica clara para esa excepcional afinidad, resultante de una también excepcional complementariedad entre el sitio de unión de la avidina y la biotina. Tal vez el secruesto de la biotina en la clara del huevo tenga un efecto inhibidor del crecimiento de bacterias que pudiesen estar presentes. Sin llegar a este extremo, los valores de Kd para las interacciones hormona-receptor son también muy bajos. En este caso sí hay una razón clara: cuanto menor sea Kd. menos cantidad de hormona habrá que liberar a la circulación que se forme un número adecuado de complejos hormona-receptor. (Ver también la página anterior)
Es importante entender que en esta página y las anteriores hemos estudiado Kd, definida como la constante de disociación del complejo P.L, desde tres puntos de vista diferentes y complementarios:
1) Como una medida de la concentración de ligando necesaria para saturar la proteína.
2) Como un parámetro relacionado inversamente con el tiempo que se mantiene formado el complejo P.L.
3) Como un parámetro relacionado inversamente con la energía que se libera cuando se forma el complejo.
Cada uno de estos enfoques nos suministra un tipo de información diferente sobre la unión del ligando a la proteína. Seguidamente veremos algunos ejemplos de complejos reales.