En la siguiente discusión, y para simplificar, vamos a considerar dos átomos neutros aislados.
Si
se acercan dos átomos inicialmente separados, y medimos las fuerzas que se
establecen entre ellos, observamos lo siguiente (en azul
atracción, en rojo repulsión)
|
|
Si inicialmente los átomos están suficientemente alejados no interaccionan entre ellos; ahora bien, al acercarse se atraen cada vez con más fuerza, debido a las fuerzas de London, que se discuten más adelante. Esta atracción aumenta rápidamente al disminuir la distancia interatómica. Por otra parte, a distancias muy pequeñas los átomos experimentan una fuerte repulsión (es la repulsión de Van der Waals) debida a las nubes electrónicas, muy juntas y que se repelen fuertemente al tener carga negativa. Esta repulsión depende de la duodécima potencia de la distancia interatómica, por lo que sólo es importante cuando la distancia interatómica es muy pequeña. Del balance (mostrado en verde) de las fuerzas anteriores, atracción y repulsión, se establece un equilibrio que es el que alcanzarían espontáneamente los dos átomos en ausencia de influencias exteriores. La distancia a la que se disponen los dos átomos es la distancia de Van der Waals. |
|
|
Esta curva de potencial se conoce como Potencial de Lennard-Jones, y se puede expresar de la siguiente forma:
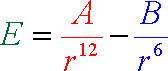
La distancia interatómica mínima a la que se pueden disponer los dos átomos es igual a la suma de los radios de Van der Waals de cada átomo. El radio de Van der Waals podemos imaginarlo como la frontera del átomo, suponiéndolo una esfera rígida. Realmente se requiere mucha energía para que dos átomos se aproximen más que la suma de sus radios de Van der Waals, si no están enlazados covalentemente entre sí, por lo que los átomos se pueden considerar como esferas rígidas con bastante precisión. Para el caso de dos iones de distinta carga la situación es similar a la descrita, aunque ahora la atracción entre ellos es mayor, ya que puede establecerse un enlace iónico. El radio iónico no coincide con el radio de Van der Waals del átomo neutro; generalmente es mayor en el caso de los aniones y menor en el caso de los cationes.
| elemento |
Radio de Van der Waals nm |
| H | 0,120 |
| C | 0,170 |
| N | 0,155 |
| O | 0,152 |
| P | 0,180 |
| S | 0,180 |
En los programas de visualización molecular (Rasmol, Chime, Jmol), en el tipo de representación denominado "espacial compacto" o "spacefill" los átomos se muestran como esferas rígidas de radio igual al radio de Van der Waals del átomo en cuestión. Cuando dos átomos están unidos por un enlace covalente, o parcialmente covalente, como es el caso del puente de hídrógeno, las esferas que los representan se intersecan. Esto quiere decir simplemente que una de las características de los enlaces covalentes es que los átomos se disponen a una distancia inferior a la de la suma de sus radios de Van der Waals, debido a que comparten los electrones del orbital u orbitales moleculares. Los orbitales moleculares NO se representan en estos programas, por lo que hay que tener presente que las imágenes resultantes son una simplificación de la estructura real de la molécula.
|
|
|
|
En la molécula de metano se puede observar como las esferas que representan a los átomos de hidrógeno están intersecadas por la esfera que corresponde al átomo de carbono central |
Dos moléculas de agua unidas por un puente de hidrógeno. Se puede apreciar que el puente de hidrógeno acerca a los dos átomos más que la distancia de Van der Waals |