El
enlace o “puente” de hidrógeno es un tipo de enlace muy particular, que
aunque en algunos aspectos resulta similar a las interacciones de tipo
dipolo-dipolo, tiene características especiales. Es un tipo específico de
interacción polar que se establece entre dos átomos significativamente
electronegativos, generalmente O o N,
y un átomo de H, unido covalentemente a uno de los
dos átomos electronegativos.
En un enlace de hidrógeno tenemos que distinguir entre el átomo DADOR del hidrógeno
(aquel al que está unido covalentemente el hidrógeno) y el ACEPTOR, que es al
átomo de O o N al cual se va a enlazar el hidrógeno.
DADOR
Un enlace O-H está muy polarizado por la elevada electronegatividad del oxígeno y por el hecho de que el único protón del núcleo del hidrógeno atrae débilmente a los electrones del enlace. Así, se estima que la carga positiva sobre el hidrógeno es de 0,4 unidades. En el caso de que el átomo electronegativo sea nitrógeno la situación es similar, aunque dada la menor electronegatividad del nitrógeno la polarización del enlace va a ser algo menor menor. Los grupos O-H y el N-H van a actuar como donadores de hidrógeno en el enlace de hidrógeno. A pesar de la similitud química el grupo S-H es un mal donador, debido a la baja electronegatividad del azufre.
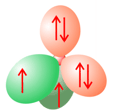
En el caso del oxígeno, con un total de 8 electrones, se presentan DOS pares de electrones solitarios, tanto en el caso de la hibridación sp3 como de la sp2:
| Sin hibridar |
|
agua |
|
| Hibridación sp3 |
|
 |
|
| Hibridación sp2 |
|
||
Los dos pares de electrones solitarios se muestran en rojo; los orbitales en verde, ocupados por un electrón cada uno, son los que van a participar en los enlaces. En el caso de la hibridación sp2, trigonal, como en el C=O (no mostrada la figura), también hay dos pares de electrones solitarios. En resumen, un átomo de oxígeno puede actuar como aceptor de dos puentes de hidrógeno.
|
Modelo de la estructura del hielo cúbico. El oxígeno de la molécula de agua central (rojo, "spacefill") acepta dos hidrógenos (en azul) de otras dos moléculas de agua vecinas. Note la geometría tetraédrica de los cuatro hidrógenos que rodean al oxígeno central |
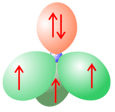
El nitrógeno tiene un electrón menos y por consiguiente presenta sólo un par de electrones solitarios, pero tiene tres electrones en orbitales que pueden participar en enlaces. Un átomo de nitrógeno puede actuar como aceptor de un solo puente de hidrógeno.
| Sin hibridar |
|
amoníaco |
|
| Hibridación sp3 |
|
 |
|
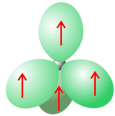
Por último, el carbono, que tiene un electrón menos que el nitrógeno, no presenta pares de electrones solitarios y puede formar 4 enlaces que, en la hibridación sp3 se disponen en la forma tetraédrica bien conocida. El carbono no puede actuar como aceptor de puentes de hidrógeno, porque ni es suficientemente electronegativo ni tiene pares de electrones solitarios.
| Sin hibridar |
|
metano |
|
| Hibridación sp3 |
|
 |
|
Otros aceptores de puentes de hidrógeno de importancia son los aniones monovalentes, principalmente el Cl-
Propiedades
El enlace de hidrógeno presenta un cierto carácter covalente. O, lo que es lo mismo, podemos considerar que el enlace resuena entre estas dos posibles estructuras:
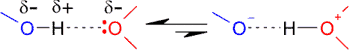
En condiciones óptimas esto supone un 10% de carácter covalente. Una consecuencia importante de esta resonancia es que se pueden intercambiar los hidrógenos de una molécula con los hidrógenos del agua disolvente. Este fenómeno se aprecia fácilmente si la molécula se disuelve en agua pesada D2O; si los hidrógenos son accesibles al disolvente, se intercambian por deuterio:
La distancia interatómica entre el hidrógeno y el aceptor es menor que la suma de sus radios de Van der Waals, (0,27 nm, aprox. para un par Oxígeno-Hidrógeno), aunque están mas separados que si estuvieran unidos por un enlace covalente puro:
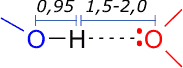 distancias en Angstrom |
La energía del enlace de hidrógeno depende del ángulo de enlace; es máxima cuando los tres átomos (dador-hidrógeno-aceptor) están alineados y disminuye cuando se disponen en ángulo. Es un enlace muy direccional aunque pequeñas variaciones de hasta 20º no tienen demasiada importancia. Por último, la energía de un enlace de hidrógeno depende de los aceptores y dadores. De mayor a menor energía de enlace tenemos las siguientes posibilidades:
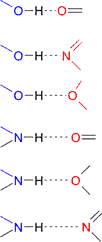 |
En condiciones óptimas la energía de un enlace de hidrógeno puede alcanzar unos 23 kJ/mol (unas 15 veces más que la energía de las fuerzas de dispersión de London).
La fuerza relativamente alta de estos enlaces y su direccionalidad hacen que sean muy importantes en la estructura de las macromoléculas. Un ejemplo bien conocido es el emparejamiento de bases en el ADN. Por ejemplo, en este par GC perteneciente a un dodecámero cuya estructura en disolución ha sido determinada por RMN, lo que permite visualizar los átomos de hidrógeno: Archivo pdb: 123D