El conjunto de fuerzas que se establecen entre moléculas o átomos, y que no se pueden considerar como enlaces covalentes o enlaces puramente iónicos se conoce colectivamente como "fuerzas de Van der Waals". Pueden ser tanto atractivas como repulsivas. Un resumen de los diferentes tipos de interacción de carácter electrostático que actúan sobre moléculas o iones se presenta a continuación:

(1): Su naturaleza depende de la carga (diferente o igual) de los grupos o iones.
(2): Su naturaleza depende de la orientación del dipolo. El valor exacto de la dependencia con la distancia depende de si el o los dipolos presentan o no libertad de movimiento
La variación de la energía de enlace en función de la distancia para este tipo de interacciones se muestra a continuación:
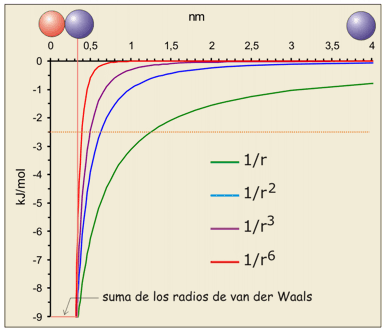 |
En resumen, se trata de interacciones que realmente tienen importancia cuantitativa exclusivamente a distancias cortas o muy cortas. Esta dependencia respecto la distancia es extremadamente importante, porque supone que la energía de la interacción entre dos moléculas depende estrechamente de lo complementarias que sean sus formas y de la adecuada orientación relativa de los grupos polarizables.