Fuerzas de Dispersión II
Importancia cuantitativa de las fuerzas de dispersión
La energía de estos enlaces, considerados individualmente, es muy débil; del orden 1,5 kJ/mol, aproximadamente el 0,5% de la energía media de un enlace covalente como mucho. De hecho, es inferior a la energía térmica media de las moléculas a temperatura ambiente, que es del orden de 2 kJ/mol. Dicho de otra forma, un único enlace de este tipo no puede mantener unidas a dos moléculas. Además, sólo son importante a distancias muy cortas: la energía del enlace depende inversamente de la sexta potencia de la distancia interatómica. Sin embargo, si el número de estos enlaces que se establecen entre dos moléculas es suficientemente elevado pueden llegar a tener una importancia significativa como ocurre en el caso de los hidrocarburos saturados. La única fuerza intermolecular que pueden experimentar son estas fuerzas de dispersión, pero a partir de un número pequeño de átomos de carbono son suficientemente intensas como para que estos compuestos sean líquidos a temperatura ambiente (lo que, entre otras cosas, favorece su empleo como combustibles). La energía total de la unión intermolecular depende del número total de enlaces, por lo que cuanto más grandes sean las moléculas, mas enlaces de este tipo pueden formar, y se unen más fuertemente.
|
Temperaturas de ebullición en ºC de hidrocarburos lineales |
||||||
| Metano | Etano | Propano | Butano | Pentano | Hexano | Decano |
| -164 | -88,6 | -42,1 | -0,5 | 36,1 | 68,7 | 164 |
A partir del butano la energía total de estas interacciones ya es suficiente para poder mantener a las moléculas de hidrocarburo en estado líquido a temperatura ambiente.
No solo es importante el número total de átomos; la forma de la molécula, que permite que se formen más o menos enlaces intermoleculares, también lo es. Así, dado que las moléculas lineales pueden empaquetarse más estrechamente que las ramificadas, sus temperaturas de ebullición son también mayores, como puede comprobarse viendo los tres hidrocarburos isómeros de cinco carbonos:
| Temperaturas de ebullición en ºC de hidrocarburos alifáticos de 5 carbonos | ||
|
|
|
|
|
pentano |
isopentano |
tetrametilmetano |
|
36,1 |
27,8 |
9,5 |
Estas fuerzas de dispersión pueden ser muy importantes donde se encuentren átomos estrechamente empaquetados, como es el interior de las bicapas lipídicas o el interior de las proteínas.
| ATENCIÓN |
|
Las fuerzas de dispersión no se deben confundir con las interacciones hidrofóbicas, que dependen básicamente de las propiedades del agua. Las fuerzas de dispersión son universales, y se producen entre cualquier par de átomos o moléculas, independientemente de que sean polares o no e independientemente del entorno donde se encuentren las moléculas. Las interacciones hidrofóbicas se llevan a cabo exclusivamente en medio acuoso. |
Otro factor importante en este tipo de interacciones atractivas entre moléculas es la polarizabilidad de la nube electrónica, esto es, la facilidad para distorsionar dicha nube. Está relacionada con el tamaño del orbital y con el número de electrones que puedan desplazarse. Estas fuerzas de dispersión son importantes en los sistemas aromáticos, porque la polarizabilidad de las moléculas aromáticas es grande, debido a que los electrones se pueden desplazar en el conjunto de los orbitales p deslocalizados. Además, dado que los anillos aromáticos son planos, se pueden empaquetar muy bien con los que las fuerzas que se crean entre ellos son relativamente elevadas. Esto se puede comprobar comparando las temperaturas de ebullición de moléculas alifáticas y aromáticas de igual numero de átomos de carbono:
| Temperatura de ebullición en ºC de hidrocarburos aromáticos y alifáticos | |||
| C6 | C10 | ||
| benceno | hexano | naftaleno | decano |
| 80,1 | 68,9 | 218 | 164 |
Las moléculas aromáticas tienen una temperatura de ebullición notablemente superior, a pesar de que su peso molecular es inferior al de los hidrocarburos alifáticos de igual número de carbonos.
Un ejemplo notable de la importancia de este enlace es el estrecho empaquetamiento de las bases en la doble hélice de los ácidos nucleicos.
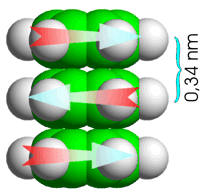 |
|
| Modelo de empaquetamiento de moléculas de benceno, con los momentos dipolares acoplados entre moléculas sucesivas. | Bases apiladas en un pequeño segmento de ADN bicatenario. |
2 Interacciones ión-dipolo inducido
La elevada polarizabilidad de los anillos aromáticos hace que se puedan producir interacciones significativas, específicamente entre grupos catiónicos de Lys o Arg y anillos aromáticos de Phe, Trp o Tyr. Son las interacciones Pi-catión, que pueden ser cuantitativamente importantes en el interior de las moléculas de proteína:
| Dos vistas de la interacción Pi-catión entre el Trp 326 y la Lys 282 de la enzima UDP-galactosa epimerasa de E. coli. La mínima separación entre el nitrógeno amínico de la lisina y el anillo aromático es de 0,394 nm. Archivo PDB: 1KVU | |
Es importante tener en cuenta que un ión, o un dipolo, puede establecer interacciones con varios iones o dipolos próximos, formando asociaciones de más de dos moléculas o grupos:
| Vista superior y frontal de la interacción múltiple iónica e ión-dipolo entre la Arg 287, el Glu 306 y la Tyr 290 de la enzima muropéptido acetilglucosamintransferasa de E.coli . Archivo PDB 1FOK. | |